Mục lục
Phần 1 SƠ LƯỢC VỀ SỰ RA ĐỜI VÀ PHÁT TRIỂN CÔNG NGHỆ BÀO CHẾ DƯỢC PHẨMPhần 2 QUÁ TRÌNH NGHIÊN CỨU, BÀO CHẾ – SẢN XUẤT THUỐC RA THỊ TRƯỜNG2.1. Quy trình nghiên cứu, chế biến – cung ứng thuốc mới2.2. Quá trình nghiên cứu, sản xuất – cấp dưỡng một dung dịch generic ra thị trườngPhần 3 HỆ THỐNG QUẢN LÝ CHẤT LƯỢNG CÁC Gx
P ÁP DỤNG trong SẢN XUẤT DƯỢC PHẨM1. CHẤT LƯỢNGCÁC NGUYÊN TẮC THỰC HÀNH TỐT (Gx
P) ÁP DỤNG vào CÁC CƠ SỞ SẢN XUẤT THUỐC (CNDP – SXT)1. NĂM YẾU TỐ CƠ BẢN CỦA CÁC Gx
P (CÒN GỌI 5 M)THỰC HÀNH TỐT SẢN XUẤT THUỐC (GOOD MANUFACTURING PRACTICE – GMP)1. MỞ ĐẦU2. HƯỚNG DẪN THỰC HÀNH TỐT SẢN XUẤT THUỐC THEO KHUYẾN CÁO CỦA TỔ CHỨC Y TẾ THẾ GIỚI (WHO GMP – WORLD HEALTH ORGANIZATION GOOD MANUFACTURING PRACTICES)Phần 3 (tiếp) THỰC HÀNH TỐT PHÕNG KIỂM NGHIỆM THUỐC (GOOD LABORATORY PRACTICE – GLP)1. MỞ ĐẦU2. NGUYÊN TẮC THỰC HÀNH TỐT PHÒNG KIỂM NGHIỆM THUỐCPhần 3 (tiếp) THỰC HÀNH TỐT BẢO QUẢN THUỐC (GOOD STORAGE PRACTICES – GSP)1. MỞ ĐẦU2. THỰC HÀNH TỐT BẢO QUẢN THUỐC – GSPPhần 4 HỆ THỐNG TIÊU CHUẨN CHẤT LƯỢNG ISO 90004.1. Sơ lược vài điều về sự thành lập của ISO và cỗ ISO 90004.2. Bộ tiêu chuẩn chỉnh ISO 9000 năm 2000 (còn call là phiên bạn dạng 2000)Phần 5 AN TOÀN LAO ĐỘNG VÀ VỆ SINH CÔNG NGHIỆP5.3. Kỹ thuật an ninh và những phương tiện, biện pháp bảo vệ người lao động
PHỤ LỤCQuy trình thao tác chuẩn (STANDARD OPERATING PROCEDURE (SOP)) vận hành cân năng lượng điện tử HR–200 (Chỉ sử dụng tác dụng cân)Quy trình thao tác chuẩn (STANDARD OPERATING PROCEDURE (SOP)) vận hành cân khẳng định độ độ ẩm bằng mặt trời SHIMADZU LIBROR EB – 340 MOCQuy trình thao tác chuẩn chỉnh (STANDARD OPERATING PROCEDURE (SOP)) quản lý máy đo p
H MELTROHMQUY TRÌNH THAO TÁC CHUẨN (SOP) THẨM ĐỊNH QUY TRÌNH VỆ SINH THIẾT BỊ
ĐẠI CƯƠNG VỀ CÔNG NGHỆ BÀO CHẾ DƯỢC PHẨMPhần 1 SƠ LƯỢC VỀ SỰ RA ĐỜI VÀ PHÁT TRIỂN CÔNG NGHỆ BÀO CHẾ DƯỢC PHẨM
1.1. Sự thành lập và hoạt động của technology bào chế dược
Thuốc luôn là một nhu cầu luôn luôn phải có được trong đời sống con người. Cũng tương tự mọi ngành khác, thuốc yên cầu một nền phân phối ngày càng cao và trở nên tân tiến theo sự cải tiến và phát triển và tiến bộ của loài người.
Bạn đang xem: Nghiên cứu bào chế là gì
Thời chi phí sử, loài bạn đã biết sử dụng thuốc từ thiên nhiên như cây, cỏ, lá, thân, rễ, vỏ cây để chữa trị bệnh, kháng lại bệnh tật và sinh tồn. Lúc đó, người ta dùng những nguyên vật liệu còn tươi, hoặc rất có thể phơi khô để dành. Dần dần, bạn ta biết cần sử dụng nước thấm ướt, rồi biết đun với nước (sắc) rước nước sắc để sử dụng – đó là dạng bào chế thô sơ thứ nhất của dược phẩm.
Khi loài fan biết lên men một số trong những thực vật đựng bột, đường, rồi biết đựng ra rượu (khoảng 1000 thời gian trước công nguyên), thì cũng từ kia một dạng thuốc đồ vật hai xuất hiện. Đó là rượu thuốc,… Ngành bào chế thuốc – technology bào chế chế phẩm đã mở ra như vậy, từ hầu hết dạng thô sơ 1-1 giản ban đầu như nước sắc, rượu thuốc, cao thuốc,…
Trải qua mấy ngàn năm lịch sử hào hùng phát triển, hiện đại của loài người, thuộc với số đông cuộc biện pháp mạng công nghệ kỹ thuật cũng giống như nhu ước ngày càng tăng thêm của con tín đồ về chống và chữa trị bệnh, kỹ thuật cung cấp thuốc cũng ngày càng cải tiến và phát triển với phần nhiều dạng thuốc tinh tế hơn, phức hợp hơn. Cụ thể là những dạng thuốc viên, viên nén, viên bao, viên nang, thuốc tính năng kéo dài, thuốc tiêm, dịch truyền,…
Đó là lịch sử dân tộc ra đời, tồn tại và cải tiến và phát triển của công nghệ bào chế các dạng dung dịch nói riêng với của nền chế tạo thuốc nói chung.
Sơ trang bị 1.1. Vị trí, mục đích của công nghệ bào chế dược phẩm đối với sức khỏe bé người
1.2. Sự cải cách và phát triển tất yếu đuối của công nghệ bào chế dược phẩm
Sự trở nên tân tiến của công nghệ bào chế chế phẩm đi liền với sự cải tiến và phát triển và hiện đại chung của nhân loại, nó đáp ứng nhu mong về dung dịch phòng, chẩn đoán với chữa bệnh ngày càng tăng thêm của toàn cầu. Rất nhiều yếu tố đặc biệt thúc đẩy technology bào chế phát triển là:
* Sự gia tăng dân số
Theo quỹ số lượng dân sinh Liên Hiệp Quốc (UNFPA) công bố trong đa số năm cách đây không lâu dân số thế giới có sự tăng vọt, mang tính chất “bùng nổ”.
Một khi số lượng dân sinh tăng, nhu yếu về thuốc cũng đề xuất tăng theo. Mức sử dụng thuốc bình quân đầu người, cứ 10 năm lại tăng vội vàng đôi. Ở Việt Nam, chỉ trong 5 năm, từ bỏ 1990 – 1995 mức áp dụng thuốc tăng cấp 10 lần. (Tuy nhiên, trên cố kỉnh giới, mức tiêu thụ đang có sự chênh lệch béo giữa các nước cải cách và phát triển và những nước đang phát triển. Người dân những nước công nghiệp thực hiện dược phẩm bình quân gấp 30 lần sinh sống nước vẫn phát triển. Ở từng quốc gia cũng đều có tình trạng tương tự như về yếu tố hoàn cảnh người dùng thuốc ngơi nghỉ thành thị với nông thôn…).
* Sự tăng thêm về bệnh tật
Chủng loại dịch tăng, bệnh dịch ngày càng gian nguy hơn vị vi trùng chống thuốc, vì chưng điều trị không đúng phác đồ vật hoặc không đủ thuốc, vị thiên tai và những nguyên nhân khác… Ví dụ dịch sốt rét, bệnh lao vẫn còn đấy là căn bệnh đe doạ hàng triệu con người trên cố giới. Tình trạng bệnh thế kỷ AIDS, côn trùng hiểm hoạ của toàn cầu và các bệnh do virus khác.
* Sự cách tân và phát triển của các ngành KH–CN khác: Công nghiệp dược dựa vào sự cách tân và phát triển của công nghiệp hoá dược (bao quấn là công nghiệp hoá học), cấp dưỡng nguyên liệu hỗ trợ cho công nghệ bào chế những dạng thuốc. Công nghiệp hoá dược hoàn toàn có thể đi tự tổng thích hợp hoá học ra những chất hoặc chiết bóc các hóa học tinh khiết từ nguyên liệu thiên nhiên, cây, con (thực vật, hễ vật). Sự cải cách và phát triển của technology bào chế thuốc còn được hỗ trợ bởi sự cung ứng nguyên liệu ngày càng phong phú của công nghiệp thuốc phòng sinh với công nghiệp sinh học. Kề bên đó, technology bào chế những dạng dung dịch còn được sự cung ứng tích cực của hiện đại khoa học tập kỹ thuật từ khá nhiều ngành, như điện tử, cơ khí, hoá học…
* roi cũng là một trong động cơ thúc đẩy công nghệ bào chế thuốc phạt triển, mặt khác đóng góp tích cực và lành mạnh cho nền tài chính xã hội
Đi song với sứ mệnh sản xuất, cung ứng thuốc mang lại y tế ship hàng công tác âu yếm và đảm bảo an toàn sức khỏe con người, technology bào chế dung dịch còn đóng góp góp một trong những phần không bé dại và tích cực cho nền tài chính – xã hội.
1.3. Vài nét về tình hình bào chế thuốc sống Việt Nam
Trước biện pháp mạng tháng Tám năm 1945: chưa tồn tại sản xuất công nghiệp, chủ yếu là nguồn từ “Pháp quốc”, gồm chăng là pha trộn theo đơn, cố gắng bào chế một vài dạng dung dịch mỡ, thuốc nước,… với phương tiện đi lại hoàn toàn thủ công bằng tay ở các bệnh viện hoặc hiệu thuốc tư nhân, tính chất trọn vẹn lệ thuộc.
Sau bí quyết mạng mon Tám năm 1945, thời kỳ binh lửa chống thực dân Pháp (1945–1954): Đáp ứng yêu cầu của cuộc chiến tranh vệ quốc, công nghệ bào chế dung dịch đã làm ra những một số loại thuốc giao hàng chiến trường, những loại thuốc thường thì cho quần chúng như thuốc cảm, sốt, ho, tiêu chảy,…, một vài vaccin cơ bản, thuốc nóng rét,… phần đa xưởng chế biến mang tính bài bản như Xưởng Quân dược XF14, LK10, LK3–4, LK5,… thứu tự ra đời. Tuy cơ sở trang thiết bị vẫn còn rất thô sơ, trường đoản cú tạo, phân phối tiểu thủ công, dẫu vậy đây chính là tiền đề mang lại nền cung ứng thuốc mang tính chất công nghiệp sau này. Thời gian này vn đã cấp dưỡng ra được một số trong những thuốc như Calci chlorid dược dụng pha tiêm, Ether mê, Chloroform mê, tách được Long não, Morphin, Strychnin, Cafein pha tiêm,…
Thời kỳ 1955–1975: Sau hiệp nghị Geneve 1954, giang sơn tạm chia thành hai miền:
Miền Bắc trọn vẹn giải phóng, yêu thương cầu đề ra cho toàn ngành là đảm bảo những thuốc đa số cho nhân dân, phấn đấu tiếp tế trong nước đa số thứ thuốc thường thì nhất, thống duy nhất “tân dược” với “đông dược”. Các đại lý tập trung đầu tiên có bài bản lớn, cơ khí hoá, lắp thêm tương đối tiến bộ lúc bấy giờ đồng hồ là xí nghiệp Dược phẩm tw 1 (XNDPTW1), xí nghiệp Dược phẩm trung ương 2 (XNDPTW2),… và bắt đầu xây dựng xí nghiệp sản xuất địa phương ở những tỉnh, phấn đấu những tỉnh thành đều phải sở hữu xí nghiệp dược phẩm (XNDP)… xây dựng bộ môn Công nghiệp Dược trên Trường Đại học tập Dược Hà Nội.
Miền phái nam còn ở trong chính sách thực dân đẳng cấp mới, công nghiệp dược cải cách và phát triển theo lối bốn bản, bao gồm cơ sở chế biến sản xuất lớn, có thiết bị hiện tại đại, cơ mà cũng có không ít cơ sở tiếp tế thủ công, thiết bị lẹo vá,… Vào quy trình này, có tầm khoảng trên 120 viện chế biến lớn nhỏ, nhưng vật liệu hoàn toàn nhờ vào nước ngoài.
Từ sau 1975: nước nhà thống nhất, ngành Dược thống nhất chỉ đạo, phương hướng từ phái mạnh tới Bắc, tận dụng tối đa mọi cơ sở vật chất, trang thiết bị sản xuất sản xuất toàn bộ những thuốc nào hoàn toàn có thể sản xuất được với đa số nguồn nguyên liệu có thể có được. Phía Nam sẽ tập đúng theo và thành lập XNDPTW 21, 22, 23, 24, 25, 26 và Liên viện bào chế 7. Tiếp đến sắp xếp lại như sau: XNDPTW 24, 25, 26 một số xí nghiệp trực thuộc địa phương cai quản như XNDP 2–9, XNDP 3–2, XN Mebiphar,… Phía Bắc, những XNDPTW1, XNDPTW2, XNDPTW3,… cùng mỗi tỉnh, thành phần nhiều đều có các cơ sở sản xuất thuốc lớn, nhỏ,… nhà trương gây ra ngành dược tiến lên chính quy tân tiến cũng như cơ chế quốc gia về thuốc vn (1996) đã chỉ ra: không ngừng mở rộng giảng dạy dỗ ở các Trường Đại học, thành lập và củng thay đội ngũ cán bộ, cử đi học nước ngoài,… cỗ Y tế cũng đã quyết định thành lập và hoạt động Bộ môn Công nghiệp Dược tại trường Đại học Y Dược tp. Hcm (Quyết định số 1899/BYT–QĐ).
GMP đã được đề cập tới từ 1984, bởi nhiều cuộc hội thảo, đào tạo về GMP.
Chính sách đất nước về thuốc vẫn được chủ yếu phủ ban hành từ 20–6–1996, theo đó có yêu cầu Công nghiệp Dược phải cung ứng 70% yêu cầu thuốc đến nhân dân vào nước, phải phấn đấu đạt tiêu chuẩn GMP, ban hành Quyết định của cục Y tế số 1516 ngày 9–9–1996 về việc triển khai áp dụng những nguyên tắc tiêu chuẩn GMP của Hiệp hội các nước Đông nam giới Á, điện thoại tư vấn tắt là ASEAN GMP, với Thông tư hướng dẫn thực hiện việc tiến hành áp dụng các nguyên tắc ASEAN GMP của bộ Y tế số 12/BYT–TT ngày 12–9–1996. Tất cả các doanh nghiệp tiếp tế dược phẩm yêu cầu GMP hoá chậm nhất là vào thời điểm năm 2005. Trường đoản cú 2005 áp dụng WHO GMP.
Từ những kim chỉ nan lớn với cơ bạn dạng của chế độ thuốc quốc gia, cùng với những đòi hỏi bức xúc của ngành Dược, nước ta đã phát hành quy hoạch tổng thể đầu tư chi tiêu phát triển ngành Dược nước ta thời kỳ 1996 – 2010, bao gồm:
Nghiên cứu giúp quy hoạch cải cách và phát triển công nghiệp hoá dược quy trình 1996 – 2010Nghiên cứu quy hoạch đầu tư phát triển công nghiệp phòng sinhQuy hoạch sản xuất, cách tân và phát triển dược liệu và các vùng thuốc Việt Nam
Quy hoạch sản xuất, cải tiến và phát triển công nghiệp bao bì dược quy trình 1996 – 2010Quy hoạch sản xuất, phát triển công nghiệp bào chế tiến độ 1996 – 2010Quy hoạch sản xuất, cải cách và phát triển và phân bố công nghiệp dược quy trình 1996 – 2010….
Nhìn chung, trong một thời hạn khá dài, từ phương pháp bao cấp chuyển sang nguyên lý thị trường, công nghệ bào chế chế phẩm nói riêng cùng công nghiệp dược nước ta nói tầm thường còn nhiều lúng túng, mặc dù cũng có thể có những góp phần nhất định, nhưng số đông không tất cả một chiến lược lâu dài. Đến nay, ngành Dược đã bao gồm những lý thuyết chiến lược phân phát triển, lộ diện lộ trình trở nên tân tiến của công nghệ bào chế dược phẩm, giao hàng đắc lực nhu yếu về dung dịch trong nước cùng xuất khẩu.
Phần 2 QUÁ TRÌNH NGHIÊN CỨU, BÀO CHẾ – SẢN XUẤT THUỐC RA THỊ TRƯỜNG2.1. Quy trình nghiên cứu, chế biến – cung ứng thuốc mới
2.1.1. Sơ đồ gia dụng tổng quát
Có thể tổng thể hoá quá trình nghiên cứu, chế tao – tiếp tế một thuốc new ra thị phần như sau:
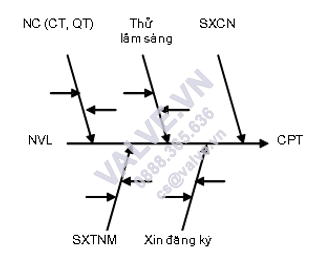
Sơ đồ 2.1. Sơ đồ tổng quát quá trình nghiên cứu và phân tích sản xuất một thuốc mới. Ghi chú: NVL: Nguyên đồ liệu: CPT: dược phẩm thuốc ; SXTNM: tiếp tế thuốc nguyên mẫu; NC(CT,QT): phân tích (Công thức, Quy trình); SXCN: tiếp tế công nghiệp.
2.1.2. Quá trình nghiên cứu, chế tao thuốc nguyên mẫu
Mục tiêu của quá trình này là tìm thấy được một công thức chế tao sản xuất xuất sắc nhất, phù hợp với những điều kiện kinh tế – kỹ thuật, trường đoản cú đó chế tao thuốc nguyên mẫu mã để test lâm sàng với xin phép cấp dưỡng đưa ra thị trường.
Người phân phối nói chung, người dược sĩ nói riêng luôn luôn luôn nỗ lực nghiên cứu tiếp tế ra đầy đủ thuốc có chất lượng, hiệu quả, an toàn. Mong muốn vậy, buộc phải xem xét siêu kỹ lưỡng phần nhiều thành tố của chất lượng. Số đông thành tố đó bao gồm rất nhiều. Đối cùng với một thuốc mới, để đưa ra được thị trường, rất cần được có sự nghiên cứu, lựa chọn:
– Đường đưa thuốc vào khung hình (đường sử dụng).
– Dạng bào chế thích hợp.
– Tá dược và chất phụ gia.
– Nguyên liệu bao bì đóng gói.
– tiến trình sản xuất.
– Kiểm tra.
– quá trình đóng gói, bảo quản...
Sự gạn lọc không thể thực hiện được nếu như thiếu sự đọc biết về hoạt hóa học cũng như toàn thể những gì về khả năng, tương quan đến hoạt chất. Trong thêm vào thuốc, việc xây dựng cách làm cho một dạng bào chế của một thuốc bắt đầu chứa hoạt chất có hoạt tính trị liệu là cực kỳ quan trọng. Để xây dựng bí quyết này phải có sự kết hợp chặt chẽ giữa đều cơ sở phân tích và cải tiến và phát triển sản xuất với đa số phòng phân tách kiểm tra. Trước hết bắt buộc hiểu biết về hoạt chất, tiếp kia là phát hành được công thức cho dạng chế tao sản xuất sau này.
2.1.2.1. Hồ hết hiểu biết về hoạt chất
Muốn tạo được bí quyết cho một thuốc new với hoạt chất gồm tính trị liệu, điều thân thiện đầu tiên, như là điểm xuất phân phát để triển khai những các bước về sau, sẽ là hoạt chất (dược chất). Hoạt chất là đối tượng người sử dụng nghiên cứu của đa số nhà khoa học: hoá học, độc hóa học học và dược lý học,... Nhà phân tích bào chế sản xuất thuốc buộc phải xem xét rút ra đông đảo nhận định, những phương châm quan sát được để có thể sử dụng vào các bước nghiên cứu giúp của mình. Những đặc thù hoá lý của hoạt chất cần được biết rõ như trình bày trong bảng 2.1.
Bảng 2.1. Những đặc thù của hoạt chất nên biết chắc chắn trước lúc đề cập nghiên cứu và phân tích một dạng chế phẩm
– đặc thù cảm quan – tính chất vật lý: tài năng hoà tan – tính chất hoá học: – thuộc về dƣợc + Sự phân phối Tính bất biến và Tƣơng kỵ – nhiệt độ độ – Độ ẩm – Oxy ko khí – Ánh sáng – các tác nhân khác | – ở trong về dƣợc + Sự phân phối + Sinh gửi hoá + Thải trừ – Hoạt tính điều trị (tác dụng điều trị) + khu vực tác dụng + Cơ chế + công dụng phụ – Sinh khả dụng |
a) đặc thù vật lý
Tính chảy của hoạt chất là 1 trong những thuộc tính cực kỳ quan trọng. Nên hiểu biết chắc hẳn rằng về sự hoà tan trong nước của hoạt chất, cũng chính vì nó sẽ mang lại hướng chắt lọc dạng thuốc sử dụng (dạng chuyển vào cơ thể) và nó đóng vai trò vai trò mập trong tính sinh khả dụng. Quan trọng hơn nữa là đều sự hiểu biết về tài năng hoà tung của hoạt chất trong nước ở đa số p
H không giống nhau và phải ghi nhận nó phân phối thế nào tùy ở trong vào p
H hay tùy ở trong vào sự gia nhập của nhị pha: nước và dầu.
b) đặc thù hoá học
Tính hóa học hoá học rất đặc trưng trong nghiên cứu độ định hình của thuốc.
– phải biết hoạt chất chịu ảnh hưởng của nhiệt độ độ không giống nhau như nắm nào.
– phải biết tác động của nhiệt độ ra sao.
– Ảnh hưởng của oxy ko khí.
– Ảnh hưởng trọn của ánh sáng,...
Và phải biết được thành phầm phân hủy sau cùng để rất có thể xác định sau đông đảo thử nghiệm về sự việc ổn định, xác định tuổi thọ hay thời hạn sử dụng thuốc.
Để biết được những điều này phải thực hiện thử nghiệm trong những điều khiếu nại nhiệt độ, độ ẩm, ánh nắng và bao gồm oxy, trường đoản cú đó dự đoán được giới hạn sử dụng thuốc (tuổi lâu của thuốc) ngơi nghỉ trong điều kiện bảo quản bình thường xuyên trên thị trường.
Một quá trình nghiên cứu vớt rất phức hợp khác nữa là những nghiên cứu và phân tích nhận biết đa số tương kỵ của hoạt chất với hầu hết thành phần khác trong thuốc cùng hoạt tính của chính nó trong môi trường xung quanh sinh học.
c) số phận của hoạt hóa học trong cơ thể
Những yếu hèn tố tương quan tới định mệnh của hoạt chất trong cơ thể thường được khảo sát bởi những nhà nghiên cứu dược lý và hoàn vớ bởi các thầy thuốc lâm sàng.
– phân tích dược đụng học, trước tiên chỉ ra cho bọn họ về sự triển lẵm của hoạt chất, sinh chuyển hoá trong cơ thể, rồi sự sa thải (thanh thải) của nó.
– Để góp cho tính năng điều trị một bí quyết hữu hiệu, chúng ta phải nỗ lực tìm hiểu, biết các về năng lực và chỗ tác dụng, cơ chế công dụng của hoạt chất.
– Một nghiên cứu không thể không có là số lượng giới hạn trị liệu, nghĩa là đưa ra được khoảng cách giữa liều chữa bệnh và liều mà lại ở kia xuất hiện tác dụng phụ tốt độc hại.
– đơn vị bào chế, thêm vào phải phân tích để biết hoạt chất xâm nhập vào cơ thể như vắt nào, trước hết phải phân tích sinh khả dụng của nó.
Trước khi phân tích công thức, cần phải có một dự kiến về cách thức thực hiện, nhằm kim chỉ nam đạt được một mô hình tối ưu sinh khả dụng xác định. Mọi yếu tố mong muốn là:
– Sự thấm kéo dài trong cơ thể.
– khẳng định những đỉnh (hấp thu) mật độ trong máu.
2.1.2.2. Công thức
Nghiên cứu chế tạo (thiết lập) cách làm cho một dung dịch mới, nhà chế biến sản xuất thuốc thường phải thân thiện tới: hoạt chất, đường mang thuốc vào cơ thể, dạng chế phẩm, đa số tá dược, bao bì đóng gói, các bước sản xuất và kiểm tra.
a) Hoạt chất hoàn toàn có thể tồn trên ở những dạng khác nhau. Sự gạn lọc tùy ở trong vào bí quyết dùng cùng những phân tích về sự ổn định, độ hoà tan cùng sinh khả dụng của thuốc.
b) Đường gửi thuốc vào cơ thể
Lựa chọn đường mang thuốc vào khung hình phụ thuộc:
– Sinh khả dụng của hoạt chất.
– Tốc độ tính năng mong muốn, thời hạn điều trị với số liều vào ngày.
– Loại người mắc bệnh ở rất nhiều lứa tuổi và thể trạng không giống nhau (sơ sinh, trẻ em em, fan lớn, bạn già,...) cũng tương tự tình trạng, bước đầu hay tái phát, trong nhà hay bệnh dịch viện, khám chữa lưu động hay không,...
– Đường uống là mặt đường thông dụng nhất, vận dụng được cho những hoạt chất.
c) Dạng thuốc, tuyển lựa dạng dược phẩm tùy ở trong vào đường dùng thuốc. Một vài dạng chế phẩm thường được nghiên cứu, áp dụng như cầm tắt sống bảng 2.2.
Bảng 2.2. Dạng dược phẩm thường dùng
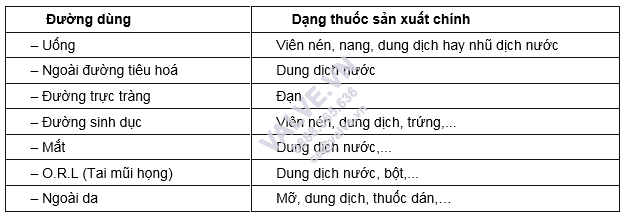
* Đường uống:
– Viên nén với viên nang là dạng thuốc rắn phân liều dễ ợt cho bảo quản, chuyển động và điều trị lưu động, dễ ợt cho cấp dưỡng công nghiệp với số lượng lớn.
– Dạng dung dịch, lếu láo dịch nước cũng là dạng dung dịch thông dụng. Dưới dạng nhiều liều, thuận lợi dùng cho một vài chủng loại bệnh nhất định.
* Đường dùng kế bên uống: ko nhiều, thường là cần sử dụng đường tiêm dưới dạng dung dịch nước. Nếu là bột tiêm, phần nhiều được đựng vào lọ, nhưng gồm một thắc mắc đặt ra cho vấn đề bảo quản.
d) những chất tá dược và phần đông chất phụ gia
Đối với phần lớn chất này, yêu thương cầu đặc biệt nhất là trơ về phương diện hoá học, không có tác dụng phụ. Để hiểu rằng tối đa sự bảo đảm an toàn về một hóa học tá dược hoặc chất phụ gia làm sao đó, người ta đang phải phân tích thành phần hoá học, độ tinh khiết,...
Sự lựa chọn ngày nay rất dễ ợt nhờ phụ thuộc vào Dược điển, hoặc mọi tài liệu nghiên cứu của những nhà phân tích công nghiệp dược tổng hợp, có có: Tên, thương hiệu khoa học, công thức hoá học (công thức nguyên, cách làm cấu tạo), trọng lượng phân tử, đặc điểm vật lý,... Và không thể thiếu những kết quả nghiên cứu của phòng bào chế thêm vào thuốc, chẳng hạn như độ trơn tung của nó,...
Nhà bào chế sản xuất đon đả tới yếu hèn tố tác động đến sinh khả dụng của thuốc, chắt lọc tá dược với quánh tính cho phép, tinh chỉnh được tốc độ giải phóng hoạt chất. Tự đó, lý thuyết sử dụng tá dược vào những kim chỉ nam nghiên cứu khác nhau hay vào hồ hết đối tượng ví dụ khác nhau.
e) vỏ hộp đóng gói là một thành phần không thể thiếu được của một dạng thuốc, bao gồm vai trò:
– bảo đảm an toàn dược phẩm (Tránh các sự biến đổi của khí hậu, ánh sáng, những nguồn gây độc hại và những va va khi vận chuyển).
– sản xuất giá trị dịch vụ thương mại cho mặt hàng (hấp dẫn khách hàng, một thể sử dụng, xác minh và hỗ trợ những thông tin quan trọng sớm nhất,...)
Cần để ý những nguyên liệu bao bì đóng gói xúc tiếp trực tiếp với dung dịch (bao bì đóng gói đầu tiên), buộc phải lựa chọn theo phía những nguyên vật liệu đã được ghi vào danh mục của các Dược điển.
Những thí điểm quan trọng cho phép xác định thời gian kéo dãn dài sử dụng (hạn dùng) một dung dịch phải triển khai trong đk có bao bì xác định.
2.1.3. Quá trình xin giấy tờ sản xuất thuốc chỉ dẫn thị trường
Hồ sơ hoàn hảo xin giấy phép sản xuất thuốc đưa ra thị trường, yêu cầu tất cả 4 phần chính:
Phần ở trong về dược (bào chế, phân tích, kiểm nghiệm,...)Phần thuộc về độc tính.Phần nằm trong về dược lý.Phần trực thuộc về lâm sàng.Hồ sơ dược thường bao gồm có:
– Thành phần, con số và chất lượng.
– tế bào tả quy trình sản xuất.
– Kiểm tra nguyên vật liệu đầu vào và bao bì.
– bình chọn trên thành phầm trung gian, cung cấp thành phẩm và thành phẩm.
– diễn tả những điều kiện bảo quản và phương pháp dùng.
Trường hợp quánh biệt cần có giải thích hợp để người dùng có sự chọn lựa đúng và chủ yếu xác. Kèm theo hồ sơ phải bao gồm những phân tích về tính ổn định định, về dược hễ học, sinh khả dụng, phạm vi điều trị cũng tương tự những điều luật yêu cầu về kỹ thuật và kinh tế.
Một điểm rất đặc biệt quan trọng cần để ý là số đông thử nghiệm lâm sàng tất yêu làm lại được theo lối cũ. Các thử nghiệm trên người là hiệu lực hiện hành một lần cho toàn bộ với những đơn vị của lô thuốc nguyên mẫu. Theo kinh nghiệm (lối cũ), mỗi lô sản xuất, gần như thử nghiệm thay thế sửa chữa bằng các thử nghiệm hoá lý cho phép xác nhận unique của thuốc.
Hồ sơ tuân theo Quy chế đăng ký thuốc, ban hành kèm theo ra quyết định Bộ Y tế.
2.1.4. Quá trình sản xuất và kiểm tra
Mục tiêu của quy trình tiến độ này là tái cấp dưỡng ở quy mô công nghiệp ra phần đa thuốc tất cả chất lượng tương xứng với unique của lô nguyên mẫu mã (lô đk sản xuất).
Ngoài ra, để đạt được mục tiêu trên, quy trình sản xuất rất cần được lựa lựa chọn theo những kim chỉ nam đã định, cũng còn tùy trực thuộc vào cả nguyên vật liệu sử dụng.
Mỗi một quy trình phải có những thông số kỹ thuật quyết định, để thuốc cấp dưỡng ra bảo đảm chất lượng toàn diện. Muốn vậy rất cần được kiểm tra chặt chẽ, từ vật liệu đầu, sản phẩm trung gian, mang đến sản phẩm sau cuối bằng rất nhiều thiết bị đúng chuẩn có độ tin cậy cao, tất cả sự thẩm định,... (kiểm tra chất lượng).
Kiểm tra sự đồng nhất giữa những lô sản xuất dựa trên tính ổn định của thuốc và trên tính sinh khả dụng của hoạt chất,...
Tóm lại tiến trình này đề xuất phải triển khai nghiêm ngặt phần nhiều tiêu chuẩn, hầu như yêu ước của GMP nhằm đảm bảo an toàn chất lượng thuốc ổn định định để đưa ra thị trường.
Quá trình nghiên cứu và phân tích một thuốc new ra thị trường yên cầu nhiều thời gian và ngân sách đầu tư khá lớn. Trước đây, tính từ lúc khi bắt đầu nghiên cứu để tìm ra được hoạt chất có tính năng đến khi thêm vào được thành phẩm bán ra thị trường, thường yêu cầu mất 10 – 15 năm và tiêu hao khoảng hàng ngàn triệu USD. Ngày nay, thời gian này rất có thể rút ngắn lại.
2.2. Quy trình nghiên cứu, bào chế – cấp dưỡng một thuốc generic ra thị trường
Thuốc generic là 1 trong thuốc có công thức hệt như thuốc nguyên thủy chọn lọc được một hay các hãng bào chế không giống nhau sản xuất khi tính chọn lọc khai thác không còn nữa.
Thực tế, khi một hãng bào chế nghiên cứu và phân tích thành công một hoạt chất mới, công hiệu cao so với một căn bệnh nào đó, thì người chủ sở hữu xin đăng ký bạn dạng quyền trí tuệ sáng tạo để kị bị sao chép, vì gồm khi bọn họ phải chi ra cả trăm triệu USD Mỹ vào nghiên cứu, nhất là với phần lớn kháng sinh.
Nhưng sau một thời gian sản xuất sản phẩm hiếm (ví dụ như 17 năm nghỉ ngơi Pháp, 15 năm ở Mỹ), dung dịch ấy trở thành chỗ đông người và toàn bộ các hãng sản xuất trên quả đât đều rất có thể sản xuất mà chưa hẳn trả phiên bản quyền sáng sủa chế.
Quá trình phân tích sản xuất một dung dịch generic ra thị trường không mất không ít thời gian với tốn nhát bằng nghiên cứu sản xuất một thuốc mới, rất có thể qua những bước như sau.
2.2.1. Phân tích tìm kiếm, lựa chọn bí quyết tối ưu
Trước hết, nhà nghiên cứu và phân tích phải tất cả một ý tưởng, chỉ dẫn một dự kiến kim chỉ nam đạt tới: dạng chế phẩm, hình thức, chủng loại mã, tiêu chuẩn, v.v…
Thực hiện phát minh đó, buộc phải phải:
– tích lũy tài liệu xung quanh mục tiêu: tư liệu trong nước, nước ngoài, về hoạt chất, về dạng chế phẩm chứa hoạt chất đó, về những chất phụ gia, về các bao bì chế phẩm đó,... Tất cả các tài liệu rất có thể phục vụ được nhiều nhất cho kim chỉ nam nghiên cứu giúp của mình.
– tò mò thị trường, quan liền kề thực tế, đa số chế phẩm đã có,... để tránh nhái lại, từ kia học tập, củng cố phát minh và dự kiến,...
– tìm kiếm kiếm nguồn nguyên vật liệu cho sản xuất tất cả chất lượng, số lượng ổn định, giá cả phù hợp,... Và tương xứng với điều kiện kinh tế – kỹ thuật hiện tại có.
– Dự con kiến công thức dựa trên những phương pháp truyền thống/kinh điển hoặc đa số tài liệu bắt đầu nhất.
– phân tách trên các công thức nhằm lựa lựa chọn ra một công thức tốt nhất, các thông số kỹ thuật kỹ thuật tối ưu nhằm bảo vệ chất lượng thuốc phù hợp với các điều kiện:
+ Kỹ thuật: chất lượng ổn định cùng với nguồn nguyên liệu hiện có, rất có thể sản xuất luôn bền dài. + Về y học: giải đáp được hầu hết câu hỏi:
1) dung dịch có tác dụng không? 2) Có công dụng phụ không? 3) Dung nạp xuất sắc không? – 4) Thuốc gồm tính sinh khả dụng,... đa số phải kiểm tra kĩ năng giải phóng hoạt hóa học (độ hoà tan) của thuốc cấp dưỡng ra theo phương pháp đó, cùng độ bình yên của thuốc.
+ Về thị trường: bạn tiêu dùng đồng ý dạng chế phẩm, áp dụng thuận tiện, dễ dàng dàng, không nhầm lẫn,...
+ Về tởm tế: ngân sách thích hợp, kết quả kinh tế,...
2.2.2. Phân tách và chế tạo tiêu chuẩn chế phẩm
Sau lúc đã chọn lựa được một công thức tốt nhất cân xứng với hầu hết điều kiện kinh tế – kỹ thuật, sẽ cung ứng thử nghiệm đạt đến việc ổn định về chất lượng và tiếp tế ra thuốc nguyên chủng loại (thuốc này đã gửi hẳn nhiên hồ sơ xin giấy phép đăng ký sản xuất), cùng đồng thời, triển khai xây dựng tiêu chuẩn.
Xem thêm: Phân Tích Bài Thơ “ Nam Quốc Sơn Hà Phân Tích Bài Sông Núi Nước Nam (14 Mẫu)
Xây dựng tiêu chuẩn chỉnh chế phẩm:
– Yêu mong kỹ thuật
Công thức: phải ghi tương đối đầy đủ tên hoạt chất, tá dược,... Con số và quality (theo tiêu chuẩn nào,...).
Nguyên đồ dùng liệu: số lượng, chất lượng,... (ghi theo hướng dẫn GMP).
– phương thức thử: nhấn xét cảm quan.
+ Định tính.
+ Định lượng.
– Thuyết minh tiêu chuẩn
+ Định tính: phương pháp, tiêu chuẩn, giải pháp tiến hành,...
+ Định lượng: phương pháp, mô tả giải pháp tiến hành, kết quả,...
Chú ý: Độ thiết yếu xác, độ tin cẩn của phương pháp
– Độ ổn định của thuốc:
Phương pháp xác minh độ ổn định định. Tế bào tả bí quyết tiến hành. Kết quả, xử trí và biện luận,…
Kết luận: Phải xác định những các bước thực hiện nay là tất cả tính khoa học và chính xác với độ tin cậy cao, được giải pháp xử lý thống kê giỏi theo phần mềm nào của sản phẩm tính,... Chú ý kèm theo mọi tài liệu gốc (photo), các bạn dạng tính toán thay thể...
2.2.3. Gởi mẫu mang đến cơ quan kiểm nghiệm
Gửi mẫu thuốc cho cơ quan lại kiểm nghiệm, kèm theo những tài liệu tương quan đến chế phẩm đó, bao gồm:
Những tiêu chuẩn xây dựng và đề nghị.
Những hồ sơ tài liệu quan trọng kèm theo (theo yêu mong của khía cạnh hàng).
2.2.4. Xây dựng các bước sản xuất (soạn thảo)
Thực hiện nay theo mẫu khuyên bảo của cơ quan cai quản (Cục Dược – bộ Y tế).
2.2.5. Tập hợp, soạn thảo hồ sơ xin đăng ký sản xuất
Theo điều khoản quy định so với thuốc chế tạo trong nước, trong bản Quy chế đăng ký thuốc ban hành kèm theo đưa ra quyết định của bộ Y tế.
2.3. Tiếp tế và kiểm tra chất lượng
Sản xuất cùng kiểm tra quality thực hiện tại theo GMP.
Phần 3 HỆ THỐNG QUẢN LÝ CHẤT LƯỢNG CÁC GxP ÁP DỤNG vào SẢN XUẤT DƯỢC PHẨM
1. CHẤT LƯỢNG
1.1. định nghĩa về thành phầm và chất lượng nói chung
* sản phẩm là kết quả của các hoạt động và của các quá trình chủ định với không nhà định, gồm thành phầm vật chất thuần tuý, phi trang bị chất, bao gồm cả dịch vụ, phần cứng và phần mềm.
* chất lượng là một tập hợp những đặc tính vốn có thỏa mãn nhu cầu các yêu mong (nhu mong hay muốn đợi đã có công bố, ngầm đọc hay bắt buộc).
1.2. Quality thuốc
Là tổng đúng theo các tính chất đặc trưng của thuốc, biểu hiện mức độ phù hợp những yêu ước đã định trước trong điều kiện xác định về kinh tế – chuyên môn – thôn hội, được biểu hiện bởi các yêu cầu sau đây:
– Có hiệu lực thực thi phòng bệnh, chữa bệnh.
– không tồn tại hoặc ít có tác dụng phụ bao gồm hại.
– Ổn định về unique trong thời gian xác định.
– tiện thể dùng, dễ bảo quản.
– vẻ ngoài hấp dẫn.
1.3. Đặc điểm với yêu mong về thuốc
– thuốc là hàng hoá quan trọng đặc biệt luôn bao gồm hai phương diện lợi cùng hại.
– thuốc là các dạng bào chế có nhiều thành phần chế tạo nên, có tính năng dược lực.
– dung dịch là một sản phẩm có các chất chất xám và technology cao.
– quality thuốc không dễ dàng nhận biết được bằng cảm quan.
– thuốc phải gắn liền với tin tức về sản phẩm.
Yêu cầu: chất lượng, hiệu quả, an toàn và khiếp tế.
2. QUẢN LÝ CHẤT LƯỢNG
là các chuyển động có phối kết hợp để lý thuyết và kiểm soát và điều hành một tổ chức triển khai về chất lượng. Việc lý thuyết và kiểm soát chất lượng nói chung bao hàm lập chính sách quality và mục tiêu chất lượng, hoạch định hóa học lượng, kiểm soát điều hành chất lượng, bảo đảm an toàn chất lượng và cách tân chất lượng
3. KIỂM SOÁT CHẤT LƯỢNG (QC)
Là sử dụng những kỹ thuật phân tích và thực hiện các hoạt động để thoả mãn các yêu cầu của hóa học lượng.
Kiểm soát chất lượng nhằm vào việc đo lường quá trình và sa thải các tại sao không tương xứng ở toàn bộ các giai đoạn thông qua việc đánh giá unique so với yêu ước đề ra. Một số hoạt động của kiểm soát unique và đảm bảo chất lượng có mối quan hệ tương tác.
4. ĐẢM BẢO CHẤT LƯỢNG (QA)
là một khái niệm rộng bao hàm toàn bộ những vấn đề độc thân hay tổng hợp ảnh hưởng đến unique sản phẩm, kể cả các nguyên liệu. Đảm bảo quality là toàn diện các planer được thực hiện nhằm mục tiêu mục tiêu đảm bảo các vật liệu và các dược phẩm đạt unique yêu cầu sử dụng.
Nói giải pháp khác, đảm bảo an toàn chất lượng là tổng thể kế hoạch, bao hàm cả GMP, được tiến hành theo trình tự, đảm bảo dược phẩm phù hợp công dụng của nó.
5. MỐI TƯƠNG quan lại GIỮA ĐẢM BẢO CHẤT LƯỢNG, GMP VÀ KIỂM TRA CHẤT LƯỢNG THUỐC
Hệ thống đảm bảo chất lượng thuốc là một trong hệ thống che phủ tất cả đa số yếu tố, những phương án được tiến hành nhằm đảm bảo các thuốc cung ứng ra các đạt quality đã đăng ký. Như vậy hệ thống này có liên quan đến tất cả các khâu, những giai đoạn, từ cá thể đến bầy đàn có ảnh hưởng đến unique thuốc. Hệ thống bảo vệ chất lượng dung dịch phải bảo đảm rằng:
* Sản phẩm được thiết kế với phải đảm bảo an toàn các yêu mong GMP, GLP, GSP.
* Các thao tác và kiểm tra unique phải theo đúng GMP (các SOP).
* Trách nhiệm thống trị phải được nêu rõ vào phần mô tả quá trình (phân định).
* Cần bố trí cung ứng và thực hiện đúng nguyên liệu, bao bì.
* Kiểm tra vật liệu đầu vào, thành phầm trung gian, bán thành phẩm, các bước sản xuất.
* sản phẩm được pha chế đúng chuẩn và khám nghiệm theo những quy trình đã định (bảo đảm cấp dưỡng và kiểm tra unique trước khi xuất xưởng).
* sản phẩm chỉ được xuất xưởng/bán khi có chứng nhận của người dân có thẩm quyền theo quy định trên giấy phép.
* bài bản bảo quản, bày bán và làm chủ sản phẩm để gia hạn chất lượng trong thời hạn hạn sử dụng của thuốc.
* bao gồm một quá trình thanh tra/tự thanh tra về chất lượng để thường xuyên reviews được tác dụng và tính khả dụng của hệ thống bảo đảm chất lượng (tổ chức tiến hành tự điều tra và tính toán chất lượng)
Tóm lại: Hệ thống bảo đảm an toàn chất lượng hoàn toàn có thể được tưởng tượng biểu diễn theo sơ đồ vật 3.1 sau:
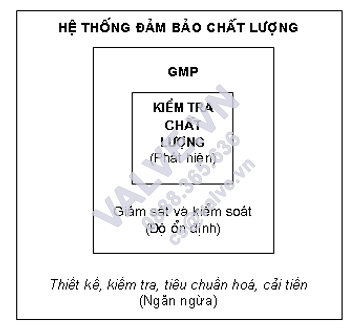
Sơ thiết bị 3.1. Quan hệ giữa Hệ thống bảo đảm chất lượng, GMP và kiểm soát chất lượng
CÁC NGUYÊN TẮC THỰC HÀNH TỐT (GxP) ÁP DỤNG trong CÁC CƠ SỞ SẢN XUẤT THUỐC (CNDP – SXT)
Thực hành giỏi sản xuất dung dịch – GMP (Good Manufacturing Practice)
Thực hành tốt phòng chu chỉnh thuốc – GLP (Good Laloratory Practice)
Thực hành tốt bảo vệ thuốc – GSP (Good Storage Practice)
1. NĂM YẾU TỐ CƠ BẢN CỦA CÁC Gx
P (CÒN GỌI 5 M)
– Con tín đồ (Man – M1)
– nguyên liệu (Material – M2)
– Môi trường, đại lý sản xuất (Millieu – M3)
– Trang sản phẩm công nghệ (Machine – M4)
– tư liệu quy trình, phương pháp,... (Method – M5)
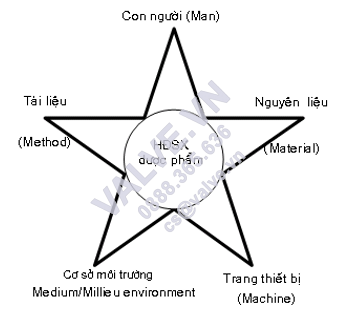
Sơ thứ 3.2. Năm yếu tố cơ phiên bản của Gx
P
1.1. Con người (M1)
Là trong số những yếu tố đặc biệt quan trọng hàng đầu, đòi hỏi:
– Đủ về số lượng, đầy đủ tiêu chuẩn
– có ý thức và thái độ quyết tâm triển khai GMP
Để đảm bảo an toàn được đều yếu tố trên đối với con người, cần phải có sự đào tạo, có huấn luyện và đào tạo thường xuyên, có kế hoạch và chương trình nuốm thể.
1.2. Vật liệu (M2)
Chỉ tất cả nguyên liệu xuất sắc mới cho sản phẩm tốt. Vật liệu bao gồm:
Hoạt chất, những chất phụ gia, tá dược, nguyên đồ dùng liệu vỏ hộp đóng gói (đóng gói trong, đóng gói ngoài),...
1.3. Môi trường, cơ sở vật chất (M3)
Địa điểm, môi trường, thiết kế, kiến tạo đúng chức năng,... Đảm bảo cấp độ dọn dẹp vệ sinh theo yêu thương cầu.
1.4. Trang sản phẩm công nghệ (M4)
Phải được trang bị phù hợp để thực hành xuất sắc theo yêu thương cầu: Đủ về số lượng, chủng loại, đồng bộ,... Đúng về đồ vật liệu, thiết kế, chế tạo, chất lượng tốt. Đặt đúng vị trí, áp dụng thuận tiện, dễ dàng vệ sinh, an toàn,...
1.5. Tư liệu (quy trình, cách thức tiến hành,…) (M5)
Hệ thống tài liệu phù hợp theo niềm tin “Viết ra hầu như gì để làm, tuân theo những gì đang viết cùng các công dụng ghi vào hồ nước sơ”, phải có rất đầy đủ quy trình, cách thức tiến hành, kiểm tra,… nói chung phải có không thiếu các tài liệu để thực hành.
2. Cha NGUYÊN TẮC CƠ BẢN CỦA CÁC Gx
P
Viết phần đa gì buộc phải làm (các hướng dẫn, quy trình, thao tác chuẩn–SOP,…)Làm theo các gì đang viếtGhi hiệu quả vào làm hồ sơ (hồ sơ hoá)
3.MƯỜI YÊU CẦU CƠ BẢN CỦA CÁC Gx
P
Viết các quy trình (các SOP)Thực hiện nay theo các quy trìnhHồ sơ hoá quá trình làm
Thẩm định
Sử dụng trang thiết bị ưng ý hợp
Bảo trì trang thiết bị
Huấn luyện, đào tạo
Sạch sẽ, trơ tráo tự, vệ sinh, ngăn nắp
Cảnh giác chất lượng
Tự thanh tra.
4. SẢN PHẨM CỦA CÁC Gx
P
– sản phẩm của GMP là thuốc (dược phẩm) với hồ hết yêu cầu: hóa học lượng, hiệu quả, an ninh và gớm tế. – thành phầm của GLP là mọi phiếu kiểm nghiệm với đa số yêu cầu: trung thực, khách hàng quan, chính xác và tin cậy. – thành phầm của GSP là gần như hàng hoá cùng với 4 yêu ước cơ bản: bảo vệ đúng điều kiện (yêu mong của thuốc), phân một số loại sắp xếp hợp lý và phải chăng (theo đúng những nguyên tắc bố dễ, FIFO, FEFO), cai quản chặt chẽ hệ thống (HSTL) và hóa học lượng đảm bảo (không bị phát triển thành đổi).
Sản phẩm của tất cả ba GPs là thành phầm thuốc thoả mãn fan tiêu dùng.
5. NỘI DUNG CỤ THỂ CỦA CÁC Gx
P
Việt nam đang vận dụng WHO GMP, GLP với GSP do cỗ Y tế ban hành.
THỰC HÀNH TỐT SẢN XUẤT THUỐC (GOOD MANUFACTURING PRACTICE – GMP)1. MỞ ĐẦU
1.1. Yêu mong khách quan lại và chủ quan
* nhu yếu về thuốc càng ngày càng tăng:
– Về số lượng:
+ bệnh tật nhiều, những bệnh lây truyền khuẩn, các bệnh tái phát,... Tình trạng bệnh thế kỷ (HIV/AIDS), và các bệnh bởi virus khác,…
– về chất lượng, người tiêu dùng đòi hỏi (PIES): tinh khiết (P: Pure), Đúng (I: Correctly Identifed), hiệu quả (E: Effective) và an ninh (S: Safe).
* Nền cung ứng thuốc vạc triển:
– Đáp ứng nhu cầu về dung dịch cho bé người.
– Đóng góp đến nền tài chính xã hội.
– Ứng dụng những văn minh kỹ thuật – công nghệ mới của những ngành như: technology hoá dược, công nghệ sinh học, technology cây thuốc, công nghệ vỏ hộp và những ngành khác ví như cơ khí, điện tử, tin học,...
* Xu núm hội nhập:
Xu thế hướng tới “nền kinh tế toàn cầu” với xu cụ “tiêu chuẩn hoá, đồng điệu hoá những luật lệ Quốc tế”. Đối cùng với thuốc, vấn đề chất lượng là vấn đề toàn cầu, được đề ra ở phần nhiều quốc gia, hầu hết nơi, phần nhiều lúc. Trong những hệ thống đảm bảo chất lượng đã được nhiều nước đưa ra và thực hành là GMP.
1.2. Reviews sơ lược GMP những nước cùng khu vực
Đã có rất nhiều nước đưa ra và triển khai GMP từ lâu.
– Hoa Kỳ là 1 trong những trong những đất nước đầu tiên cố gắng thống trị ngành dược. Sau một vài sự kiện xẩy ra liên quan tới sức mạnh con người, năm 1962, một luật đạo về thực phẩm, thuốc và mỹ phẩm được Cơ quan quản lý thực phẩm và chế phẩm Hoa Kỳ (FDA) thông qua, ra đời những quy định đầu tiên về GMP.
+ Năm 1963: GMP ấn phiên bản lần sản phẩm công nghệ nhất.
+ Năm 1975: gợi ý về thẩm định ra đời (sau vụ 11 ca tử vong bởi thiếu kiểm tra trong lúc sản xuất thuốc).
+ Năm 1976: Một cỗ GMP bắt đầu ra đời, với trung tâm hướng vào thẩm định và đánh giá và bảo vệ chất lượng hơn là đánh giá chất lượng.
+ Năm 1978: GMP ấn phiên bản lần vật dụng hai.
+ Năm 1979: GMP trở thành biện pháp và yêu cầu những nhà sản xuất bắt buộc có những quy định về thao tác chuẩn chỉnh được phê chăm chú và các khối hệ thống được thẩm định.
+ Năm 1984, qua sự kiện Tylenol fan ta nên xem xét lại trong quy chế những vấn đề tương quan đến đóng gói.
– Úc: GMP ấn phiên bản lần trước tiên từ 1969.
– Anh:
+ Năm 1971: GMP ấn phiên bản lần đồ vật nhất.
+ Năm 1977: GMP ấn bản lần sản phẩm hai.
+ Năm 1983: GMP ấn bạn dạng lần vật dụng ba.
+ Năm 1993 tiến hành GMP – EEC.
+ Năm 1995 BPF – GMP xuất bản lần trang bị ba.
Cộng đồng châu Âu ECC: phát hành tài liệu trả lời về GMP – châu Âu vào thời điểm tháng 1/1989.
Tổ chức Y tế trái đất (WORLD HEALTH ORGANIZATION – WHO):
* Năm 1967: phát hành bản dự thảo “Draft requirements for good manufacturing practice in the manufacture and unique of drugs và pharmaceutical specialities”.
* Năm 1968: ban hành GMP như là một phụ lục trong report lần máy 22 của WHO và sau đó được chuyển vào bạn dạng phụ lục của The International Pharmacopoeia. 1971.
* Năm 1969: ban hành văn bạn dạng GMP như là một trong những phần trong Certification Scheme on the unique of Pharmaceutical Products.
1975: chỉnh sửa ban hành lại.
* Năm 1992: xuất bạn dạng GMP sẽ được chỉnh sửa và ngã sung. Xuất bạn dạng “Validation of analytical procedures used in the examination of pharmaceutical materials”.
* Năm 1999: xuất bạn dạng “ Good manufacturing practices và inspection”.
* Năm 2000: “Guide lớn good manufacturing practice for medicinal plants”.
* Năm 2003: xuất bạn dạng phụ lục 4 “Good Manufacturing Practices for pharmaceuticals: main principles” trong loạt báo cáo kỹ thuật của WHO No.908.2003. – ASEAN:
* 1984 xuất phiên bản đầu tiên bao gồm 2 phần.
* 1988 xuất bạn dạng lần sản phẩm công nghệ hai.
* 1996 xuất bản lần lắp thêm ba.
– Việt Nam: kể tới GMP tự 1984 và tổ chức các cuộc hội thảo, hướng dẫn GMP vào hầu như năm tiếp theo 1987,... 1997,... Trên Hà Nội, TP. Hồ nước Chí Minh, cần Thơ, v.v...
Từ 1996 bước đầu áp dụng ASEAN GMP. Từ thời điểm năm 2005 vận dụng WHO GMP.
1.3. Phương châm và vai trò của GMP
Mục tiêu của GMP nhằm đảm bảo an toàn một cách chắc chắn là rằng chế phẩm được thêm vào ra một bí quyết ổn định, luôn luôn luôn đạt quality như vẫn định sẵn (như thuốc nguyên chủng loại đã đăng ký).
Vị trí và vai trò của GMP là một phần tử của công tác đánh giá quality nhằm bảo đảm các sản phẩm được chế tạo và kiểm soát đồng nhất để tiêu chuẩn chất lượng cân xứng với mục tiêu sử dụng cùng theo yêu cầu của giấy phép lưu hành. Nói phương pháp khác, GMP là 1 trong yếu tố cơ bạn dạng của bảo đảm chất lượng, bởi nó thực hiện phương châm phòng sai lỗi hơn chữa trị sai lỗi, tạo lòng tin cho khách hàng hàng.
GMP là toàn cục những khuyến cáo cần thực hiện để cho phép đảm bảo an toàn chất lượng của một thuốc xác định trong điều kiện giỏi nhất. Những lời khuyên này trình bày những mục tiêu khác biệt cần đạt tới liên quan liêu đến các nội dung như tổ chức, con người, cơ sở trang thiết bị,... Cũng như các bí quyết kiểm tra đề xuất thiết, kiểm soát từ khâu nguyên liệu đầu vào đến quy trình sản xuất, thành phẩm, v.v... Và cũng chỉ ra các phương tiện cần thiết để bảo đảm an toàn chất lượng thuốc giới thiệu thị trường
Theo Anh 1983, GMP là phần nhiều hướng dẫn nhằm lời khuyên các biện pháp mà các nhà sản xuất nên tuân theo mỗi khi quan trọng và phù hợp, nhằm bảo đảm sản phẩm tất cả đủ đặc điểm và chất lượng như hy vọng muốn, đạt mục tiêu đã định. Nói một giải pháp khác GMP giúp cho nhà sản xuất: cung cấp ra hầu như thuốc có unique ổn định như thuốc đk đã được cấp chứng từ phép sản xuất. đa số thuốc có các thuộc tính: tinh khiết (P), đúng (I), kiến hiệu (E) và an ninh (S) – (PIES).
1.4. Điểm qua GMP ASEAN
Trên các đại lý năm nhân tố và những nguyên tắc cơ bản của Gx
P, ASEAN GMP rõ ràng hoá ra 10 điều khoản và 4 phụ lục như sau:
+ 10 điều khoản:
Các luật pháp chungNhân sự
Nhà xưởng
Thiết bị, dụng cụ
Biện pháp vệ sinh và tiêu chuẩn vệ sinh
Sản xuất
Kiểm tra chất lượng
Tự thanh tra
Xử lý khiếu nại, tịch thu và sản phẩm trả về.Tài liệu
+ 4 Phụ lục là:
1/ thêm vào các thành phầm sinh học.
2/ Sản xuất những chất khí Y học.
3/ Sản xuất lọ xịt phân liều có áp lực.
4/ Sản xuất những chế phẩm Y học tập dẫn xuất từ huyết người...
2. HƯỚNG DẪN THỰC HÀNH TỐT SẢN XUẤT THUỐC THEO KHUYẾN CÁO CỦA TỔ CHỨC Y TẾ THẾ GIỚI (WHO GMP – WORLD HEALTH ORGANIZATION GOOD MANUFACTURING PRACTICES)
Qua phần giới thiệu, họ đã biết được các nguyên tắc chung, những thuật ngữ cần sử dụng trong tư liệu này và quan niệm về cai quản chất lượng trong công nghiệp dược. Trên cửa hàng năm yếu hèn tố, những cách thức và các yêu cầu cơ bạn dạng của Gx
P, WHO GMP đã đề ra những nội dung ví dụ trong các chương mục, ví dụ như về con tín đồ (ở mục 9, 10, 11: nhân sự, đào tạo, dọn dẹp và sắp xếp cá nhân); về cơ sở vật chất, bên xưởng, môi trường được ghi sống mục 12; về lắp thêm móc, trang đồ vật ghi làm việc mục 13; về vật liệu ở mục 14 (nguyên liệu đầu vào, dược chất – các hoạt chất, tá dược) và hồ sơ tài liệu sống mục 15. GMP WHO quan lại tâm sâu sắc tới phân phối và kiểm định theo phù hợp đồng được trình bày trong mục 2 với 7. Thẩm định quy trình sản xuất là vụ việc dễ lơ là trong các cơ sở cung cấp thuốc, sẽ được đề ra ở mục 4 với vệ sinh chặt chẽ ở mục 3 và 11. Ví dụ theo trình từ sau:
WHO GMP – nội dung 17 điều khoản
Đảm bảo quality (quality assurance)Thực hành tốt sản xuất dung dịch (GMP)Vệ sinh cùng điều kiện dọn dẹp (sanitation & hygiene)Đánh giá chỉ và thẩm định và đánh giá (qualification & validation)Khiếu vật nài (complaint)Thu hồi sản phẩm (product recalls)Sản xuất và kiểm định theo vừa lòng đồng (contract production và analysis)Tự thanh tra cùng thanh tra chất lượng (self–inspection and quality audits)Nhân sự (personnel)Đào chế tác (training)Vệ sinh cá thể (personal hygiene)Nhà xưởng (premises)Thiết bị (equipment)Nguyên vật liệu (materials)Hồ sơ tài liệu (documentation)Thực hành giỏi trong tiếp tế thuốc (good practices in production)Thực hành tốt kiểm nghiệm (good practices in chất lượng control)Ngoài ra, còn có phần lý giải phụ đã có điều chỉnh bổ sung nhằm cải tiến và phát triển thêm các hướng dẫn new trong tương lai. Ví dụ: GMP – rất nhiều dược phẩm chăm biệt như dược phẩm tiệt trùng, các sinh phẩm, chế tác sinh học thử lâm sàng bên trên người, dược thảo. Tất cả các tài liệu này có thể truy cập trên trang web
WHO: (http.www.who.int/medicines/organization/qsm/activities/qualityassurance/gmpcover/htmlo).
2.1. Đảm bảo hóa học lượng
2.1.1. Đảm bảo chất lượng: như đang trình bày tại vị trí Các quan niệm cơ bản
2.1.2. Hệ thống đảm bảo chất lượng tương xứng cho thêm vào dược phẩm: như sẽ trình bày ở trong phần Các định nghĩa cơ bản
2.1.3. Nhà cấp dưỡng phải phụ trách về chất lượng sản phẩm để bảo vệ là chúng phù hợp với mục đích sử dụng, tuân theo những quy định trong giấy tờ phép giữ hành. Mục tiêu chất lượng được thực hiện phụ thuộc vào trách nhiệm các nhà thống trị cao cấp, các phòng ban vào công ty, bên cung cấp, phân phối. Có hệ thống bảo đảm chất lượng phối hợp cả GMP lẫn soát sổ chất lượng. Vận động Hệ thống bảo vệ chất lượng yêu cầu được lưu trữ hồ sơ tương đối đầy đủ và theo dõi. Bao gồm đủ nhân viên, đại lý vật hóa học nhà xưởng, vật dụng móc, trang sản phẩm công nghệ phù hợp.
2.2. Thực hành xuất sắc sản xuất thuốc (GMP)
GMP là một phần của Đảm bảo chất lượng, giúp đảm bảo an toàn rằng thành phầm được sản xuất đồng điệu và kiểm soát theo đúng những tiêu chuẩn chất lượng phù hợp với mục đích sử dụng của chúng, cũng tương tự theo đúng những quy định của bản thảo lưu hành.
2.3. Nguyên tắc dọn dẹp và sắp xếp và thực hành dọn dẹp (NTVS cùng THVS)
Các bề ngoài và thực hành lau chùi và vệ sinh phải được triển khai nghiêm ngặt trong quy trình sản xuất.
Phạm vi thực hiện: nhân viên, nhà xưởng, đồ đạc thiết bị, vật liệu đầu vào,… bất kỳ thứ gì có thể là mối cung cấp lây nhiễm so với sản phẩm. Gồm chương trình toàn diện (trình bày chi tiết ở từng mục, như mục 11: dọn dẹp vệ sinh cá nhân, mục 12: bên xưởng).
Ví dụ:
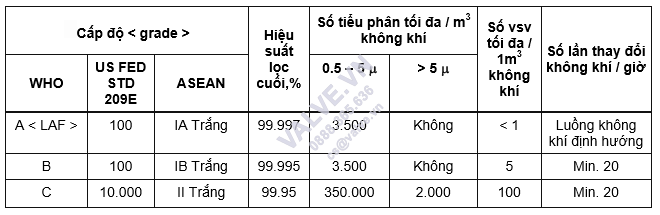
Bảng 3.1. Tiêu chuẩn chỉnh cấp dọn dẹp và sắp xếp (của WHO với ASEAN)
2.4. Thẩm định
Thẩm định là một phần cơ phiên bản trong GMP và cần phải được triển khai theo đúng đề cương đã định. Buộc phải lập ra các quy trình thao tác (SOP) và các bước sản xuất dựa trên cơ sở một nghiên cứu thẩm định và cần được đánh giá lại theo chu kỳ để bảo vệ rằng các quy trình này vẫn đảm bảo an toàn cho kết quả mong muốn. đề nghị đặc biệt để ý đến việc thẩm định những SOP trong trộn chế, kiểm định và làm vệ sinh.
Thẩm định là hành động nhằm hội chứng minh, bằng những phương tiện thích hợp hợp, rằng đông đảo nguyên liệu, thừa trình, quy trình, hệ thống, sản phẩm được áp dụng trong tiếp tế hay kiểm tra, đã tạo ra một cách ổn định những tác dụng như muốn muốn. Thẩm định tiến trình sản xuất, những quy trình phân phối trọng yếu bắt buộc được đánh giá cả trước và sau khi thực hiện.
2.5. Năng khiếu nại
2.5.1. Nguyên tắc
Tất cả các khiếu nề và các thông tin khác liên quan đến sản phẩm có chức năng bị không đúng hỏng hồ hết phải được xem như xét theo những quy trình bởi văn phiên bản và các biện pháp xung khắc phục rất cần phải thực hiện.
2.5.2. Thực hành
Có 10 nội dung cụ thể (xem cụ thể tài liệu tham khảo) như:
– phân công người chịu trách nhiệm xử lý các khiếu nằn nì và đưa ra quyết định biện pháp khắc phục.
– có SOP tế bào tả biện pháp tiến hành, tất cả khi yêu cầu phai thu hồi. Nên đặc biệt để ý đến số đông khiếu nề về giả mạo. Cần ghi thành hồ nước sơ đầy đủ chi tiết bất kỳ khiếu nại nào liên quan đến sai lỗi sản phẩm. đông đảo khiếu nại này nên được điều tra thấu đáo.
– tất cả các ra quyết định và biện pháp xử lý về khiếu nại đều bắt buộc ghi vào hồ nước sơ.
– làm hồ sơ về năng khiếu nại cần phải rà soát liên tục để tìm kiếm ra số đông dấu hiệu riêng biệt hoặc tái diễn và có đủ triệu chứng lý để tịch thu những thành phầm đang lưu hành.
– Cần thông tin cho cơ quan có thẩm quyền,…
2.6. Tịch thu sản phẩm
2.6.1. Nguyên tắc
Cần phải gồm một khối hệ thống thu hồi nhanh chóng, công dụng các sản phẩm đã biết hoặc ngờ vực bị không đúng hỏng.
2.6.2. Thực hành
Có 7 câu chữ (xem ví dụ Tài liệu tham khảo) như:
– Cử một người chịu trách nhiệm điều hành và kết hợp việc thu hồi.
– tất cả SOP được kiểm tra, cập nhật thường xuyên giúp cho tổ chức triển khai thu hồi.
– nên hướng dẫn điều kiện bảo vệ những thành phầm đã tịch thu ở khu vực bóc tách biệt.
– Đảm bảo sẵn sàng cung ứng hồ sơ bày bán sản phẩm cho những người chịu trách nhiệm.
– Ghi









